Muchas veces la ciencia puede no ser muy atractiva para algunas personas... es por eso que la idea de este Blog es mostrarles lo asombrosa que puede ser...Cuando se abre una puerta al mundo de la ciencia, lo único que se encuentran son más y más puertas, conexiones y puentes entre las diferentes disciplinas, y todo empieza a verse con una claridad diferente, como si lo que antes parecía inmerso en la neblina ahora saliera a la luz y fuera facil de apreciar
lunes, 9 de noviembre de 2015
sábado, 24 de octubre de 2015
lunes, 25 de agosto de 2014
Recacción del permanganato con glicerina
Este experimento es peligroso. Hay que tomar las medidas de seguridad necesarias.
Materiales
Permanganato potásico
Glicerina
Vidrio de reloj u otro tipo de recipiente
Precauciones
Esta reacción es fuertemente exotérmica por lo que hay que tomar las precauciones necesarias.
Este experimento debe realizarse siempre en presencia de un adulto conocedor de los riesgos.
Medidas preventivas
Guantes
Mascarilla
Gafas de seguridad
Procedimiento
Esta prácica es muy sencilla y llamativa. Primero ponemos un poco de permanganato en el vidrio de reloj y añadimos la La reacción es inmediata y muy exotérmica. Respecto a las cantidades a emplear no tiene demasiada importancia. Solo a tener en cuenta que el permanganato es un producto caro, por lo que lo haremos a pequeña escala.
¿Qué sucede?
El permanganato potásico es un oxidante muy fuerte y se usa como tal en muchos procesos de la industria química, especialmente en la producción de compuestos orgánicos sintéticos. El permanganato, en contacto con sustancias orgánicas provoca incendios. La glicerina es un tipo de alcohol que forma parte de las grasas y que contiene tres grupos hidróxilo. La reacción entre el permanganato y la glicerina es la siguiente:
14 KMnO4 + 4 C3H5(OH)3 –> 7 K2CO3 + 7 Mn2O3 + 5 CO2 + 16 H2O + CALOR
Se produce un gran desprendimiento de calor acompañado de una llamarada de color púrpura.
Se puede utilizar esta reacción como demostración de cómo se puede quemar un alcohol sin necesidad de llama.
domingo, 24 de agosto de 2014
Bienvenidos mis queridos clinicos
Sus inicios se
remontan a las épocas de Babilonia y el Egipto Antiguo, sin embargo, dado que
anteriormente los seres humanos no sabían que existían organismos microscópicos
y en consecuencia ignoraban también que estaban utilizando seres vivos para
producir pan, cerveza y otros productos, se considera que la microbiología
comenzó sólo un par de siglos atrás de nuestra época. Datos históricos revelan
que la intuición de que existían organismos vivos tan pequeños que eran
invisibles para los ojos del hombre datan desde el 200 aC. Antes de esto ya
había personas que creían algo parecido, pero con la gran diferencia de que no
se imaginaban que estuvieran vivos.
Con la invención del microscopio por Leewenhoek (1632-1723), la existencia de los microorganismos dejó de ser intuición pura y se convirtió en una certeza; sin embargo pocos fueron los que mostraron fascinación en lo que los microscopios revelaban. En realidad, el tema cobró interés para la comunidad científica cuando Pasteur (1822-1895) rompió con la teoría de la generación espontánea mostrando cómo un medio puede permanecer estéril aún permaneciendo comunicado con el exterior usando los frascos "cuello de ganso", cuyas protuberancias impiden el paso a los microbios. Pasteur demostró también que esos organismos eran los causantes de las enfermedades y no los fermentos de los medios en putrefacción, así como que los microorganismos presentan tipos específicos de fermentación como medio anaeróbico para obtener energía. Jhonn Tyndall complementó las ideas de Pasteur al observar que los microorganismos presentan diferencias considerables en la capacidad para resistir altas temperaturas.
Los problemas más importantes a los que se enfrentaron los primeros investigadores fueron:
Con la invención del microscopio por Leewenhoek (1632-1723), la existencia de los microorganismos dejó de ser intuición pura y se convirtió en una certeza; sin embargo pocos fueron los que mostraron fascinación en lo que los microscopios revelaban. En realidad, el tema cobró interés para la comunidad científica cuando Pasteur (1822-1895) rompió con la teoría de la generación espontánea mostrando cómo un medio puede permanecer estéril aún permaneciendo comunicado con el exterior usando los frascos "cuello de ganso", cuyas protuberancias impiden el paso a los microbios. Pasteur demostró también que esos organismos eran los causantes de las enfermedades y no los fermentos de los medios en putrefacción, así como que los microorganismos presentan tipos específicos de fermentación como medio anaeróbico para obtener energía. Jhonn Tyndall complementó las ideas de Pasteur al observar que los microorganismos presentan diferencias considerables en la capacidad para resistir altas temperaturas.
Los problemas más importantes a los que se enfrentaron los primeros investigadores fueron:
a) el origen de
los microorganismos
b) la
clasificación y su relación con organismos superiores
c) causas de la
fermentación
d) cura de
enfermedades
En 1838,
Erenberg fue el primero en diseñar el primer criterio de clasificación de
bacterias: dependiendo de la forma, las bacterias podían ser catalogadas
como bastones, espiroquetas (espiral) y cocos (esféricos).
Se considera que
la microbiología moderna comenzó con los trabajos de Joseph Lister (1827-1912);
Lister fue el primero en curar heridas infectadas al notar que lo que llamamos
putrefacción en los objetos no es sino lo mismo que lo que reconocemos como
infección en los seres vivos. En el método antiséptico de Lister se usaba ácido
fénico como desinfectante al aplicarlo directamente sobre las heridas, y es el
modelo seguido por el método aséptico propuesto por Morton en 1846 que se usa
hoy en día; la técnica es desinfectar primero los utensilios que entrarán en
contacto con la herida.
Los grandes avances en la construcción de microscopios desarrollados por Ernest Abel, permitieron a Koch (1843-1910) realizar grandes aportaciones como el aislamiento de cultivos puros de microorganismos reproduciendo microbios en una placa de gelatina sólida "método de placa" (base del método actual), así como la caracterización del Mycobacterium tuberculosis, Staphyloccocus aureus, el espirilo del cólera, etc. por medio de lo que conocemos como los "Postulados de Koch" (lo que le valió el premio Nobel). Koch aclara que para caracterizar un microorganismo se requiere la presencia del mismo en todos los casos de enfermedad, después se debe extraer una muestra para realizar un cultivo puro (axénico), y que al entrar en contacto el cultivo con un organismo sano debe producir la misma enfermedad; finalmente, el microorganismo se aisla y debe comprobarse que es idéntico al original.
Actualmente, el conocimiento microbiológico se ha especializado tanto que lo encontramos dividido:
Los grandes avances en la construcción de microscopios desarrollados por Ernest Abel, permitieron a Koch (1843-1910) realizar grandes aportaciones como el aislamiento de cultivos puros de microorganismos reproduciendo microbios en una placa de gelatina sólida "método de placa" (base del método actual), así como la caracterización del Mycobacterium tuberculosis, Staphyloccocus aureus, el espirilo del cólera, etc. por medio de lo que conocemos como los "Postulados de Koch" (lo que le valió el premio Nobel). Koch aclara que para caracterizar un microorganismo se requiere la presencia del mismo en todos los casos de enfermedad, después se debe extraer una muestra para realizar un cultivo puro (axénico), y que al entrar en contacto el cultivo con un organismo sano debe producir la misma enfermedad; finalmente, el microorganismo se aisla y debe comprobarse que es idéntico al original.
Actualmente, el conocimiento microbiológico se ha especializado tanto que lo encontramos dividido:
§ a) la microbiología
médica estudia los microorganismos patógenos y la posible cura para las
enfermedades que producen
§ b) la inmunología
averigua las causas de la aparición de las enfermedades desde una perspectiva
inmunológica
§ c) la microbiología
ecológica estudia el nicho que le corresponde a los microorganismos en el
medio
§ d) la microbiología
agricultural las relaciones existentes entre plantas y microorganismos
§ e) la biotecnología
los posibles beneficios que pueden suponer para el hombre la explotación de
microbios
jueves, 25 de octubre de 2012
Enlace químico

En química, un dato experimental importante es que sólo los gases nobles y los metales en estado de vapor se presentan en la naturaleza como átomos aislados, en la mayoría de los materiales que nos rodean los elementos están unidos por enlaces químicos.
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
Molécula de H2 |
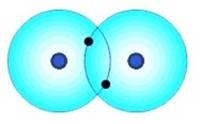
1s1 1s1
|
Cuando dos átomos se acercan se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantenerlos unidos, otras tienden a separarlos.
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Electrones de Valencia
Ya que arriba lo mencionamos, veamos este concepto.
En la mayoría de los átomos, muchos de los electrones son atraídos con tal fuerza por sus propios núcleos que no pueden interaccionar de forma apreciable con otros núcleos. Sólo los electrones que ocupan los niveles de energía más alejados del núcleo de un átomo pueden interaccionar con dos o más núcleos. A éstos se les llama electrones de valencia (sobre los niveles de energía Ver: Configuración electrónica).
La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
|
|
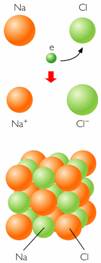
| La ilustración describe cristales de Cloruro de sodio (enlace químico iónico). |
Aquí debemos recordar que el número de electrones de valencia de un átomo es igual al número de su familia o grupo (que corresponden a las 18 divisiones verticales) en la tabla periódica, usando sólo la antigua numeración romana.
Así, tenemos un electrón de valencia para los elementos de los grupos IA (o grupo 1) y IB (o grupo 11); dos electrones de valencia para los elementos de los grupos IIA y IIB (o grupos 2 y 12), y cuatro para los elementos de los grupos IVB y IVA (o grupos 4 y 14).
(Ver: Tabla Periódica de los Elementos).
Todos los átomos de los gases nobles (o sea: neón, argón, criptón, xenón y radón) tienen ocho electrones de valencia, excepto el helio, que tiene dos. Los elementos de las familias (grupos) cercanas a los gases nobles tienden a reaccionar para adquirir la configuración de ocho electrones de valencia de los gases nobles.
Esta configuración electrónica de los gases nobles les comunica inactividad química y una gran estabilidad.
Esto se conoce como la regla del octeto de Lewis, que fue enunciada por el químico estadounidense Gilbert N. Lewis.
Regla del octeto
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, esta configuración les proporciona gran estabilidad.Estructura o Notación de Lewis
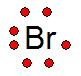 |
La estructura de Lewis fue propuesta por Gilbert Lewis, la cantidad de electrones de valencia se representan con puntos alrededor del elemento químico (símbolo), como vemos a la derecha en el ejemplo del Br.
Ver en Youtube:
http://ampliacionfq3eso.blogspot.com/2009/02/enlace-covalente-notacion-de-lewis.html
Valencia electroquímica
Se llama valencia electroquímica al número de electrones que ha perdido o ganado un átomo para transformarse en ion. Si dicho número de electrones perdidos o ganados es 1, 2, 3, etcétera, se dice que el ion (o ión) es monovalente, bivalente, trivalente, etcétera.
Iones
Los átomos están constituidos por el núcleo y la corteza (capas o niveles de energía que ocupan los electrones). El número de cargas positivas (cantidad de protones) del núcleo es igual al número de electrones que giran en la corteza; de ahí su electronegatividad (que en estado neutro es cero, y significa igual cantidad de protones a igual cantidad de electrones). Si la corteza electrónica de un átomo neutro pierde o gana electrones se forman los llamados iones.
Entonces, los iones son átomos o grupos atómicos que tienen un número mayor o menor de electrones que de protones.
En el primer caso (más electrones) los iones tienen carga negativa y reciben el nombre de aniones, y en el segundo (menos electrones) están cargados positivamente y se llaman cationes.
Ver: PSU: Química; Pregunta 06_2006
Elementos electropositivos y electronegativos
Se llaman elementos electropositivos aquellos que tienen tendencia a perder electrones transformándose en cationes; a ese grupo pertenecen los metales.En cambio, elementos electronegativos son los que toman con facilidad electrones transformándose en aniones; a este grupo pertenecen los metaloides.
Los elementos más electropositivos (tendencia a perder electrones) están situados en la parte izquierda del sistema o tabla periódica; son los llamados elementos alcalinos. A medida que se avanza en cada período hacia la derecha va disminuyendo el carácter electropositivo, llegándose, finalmente, a los alógenos de fuerte carácter electronegativo (elementos con tendencia a tomar electrones).
A modo de resumen:Ion: átomo o conjunto de átomos que poseen carga eléctrica (han cedido o han captado electrones).Catión: ion con carga positiva (ha cedido electrones). Ejemplo: Ca+2 ion calcio, NH4+ ion amonio Anión: ion con carga negativa (ha captado electrones). Ejemplo: Br– ion bromuro, ClO2– ion clorito |
Suscribirse a:
Entradas (Atom)